植物分子遺伝育種学研究室
日渡 祐二(ファームビジネス学科/教授)
1. はじめに -研究概要-
古代から連続する生命
現在、地球には約135万種の生物が存在します。このような様々な生物は、今から約38億年前もの昔に誕生した共通の祖先を出発点にしています。ドイツの医学者ルドルフ・ウィルヒョー(Rudolf Ludwig Karl Virchow, 1821-1902)が“全ての細胞は他の細胞から由来する”と述べたように、生命誕生以来、細胞が分裂し増えることにより、生命の営みが連続的に引き継がれています(図1)。私たちは、生命の連続性の基盤となるような形質のしくみ、そして生命が連続する過程で多様な生物種が生み出されるしくみを明らかにしたいと考えています。そのため、本研究室では、(1)現生生物の分裂や成長の制御メカニズムを明らかにすること、(2)現生生物の分裂や成長のメカニズムを比較することにより、多様な生物種や形質が共通の祖先からどのように生み出されたかを理解すること、そして(3)生物の分裂や成長のメカニズムを基に、新たな機能をもつ生物を創出することを目指します。
具体的には、陸上植物(コケ植物、被子植物など)を研究対象に、細胞分裂や伸長、幹細胞分化や再生、形態形成、環境応答等の制御機構の解明、および分子育種技術を用いた植物機能の開発を行っています。
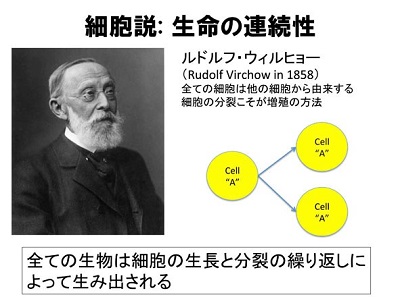
図1 細胞から細胞が生まれる
世界を救う植物細胞工学
21世紀は大気中の二酸化炭素濃度の上昇による環境変化、人口増加による食料やバイオマス不足などの様々問題に直面しています。このような問題を解決し、持続可能な資源循環型社会を構築するためには、二酸化炭素を食料やバイオマスに変換できる植物の活用が鍵になると考えられます。本研究室では、植物の有用形質を制御するメカニズムを解明し、得られた知見に基づいてて植物を社会に活用することを目指しています。特に食資源に重要な穀類や豆類に関する基礎研究に焦点を当て、食料増産のための分子基盤の解明や高付加価値植物の作出を行っています。また、そのために必要となる分子育種法や細胞工学技術の開発を行っています。
2. 研究内容
植物細胞の分裂と成長
細胞分裂では核分裂、細胞質分裂に伴い細胞小器官が非常にダイナミックにふるまいます(図2)。私たちはヒメツリガネゴケを材料に用いて細胞分裂中の細胞小器官の動態を詳細に解析できるライブイメージングの実験系を確立しました(Hiwatashi et al. 2008)。細胞質分裂は細胞分裂の最終過程で、この過程で細胞質が二分されます。陸上植物において、細胞質が分かれるときにできる仕切りは、細胞板と呼ばれます。細胞板は、細胞骨格と膜小胞からなるフラグモプラストを介して形成されます。細胞質分裂では、まずフラグモプラストが細胞中央部に形成され、しだいに微小管の重合・脱重合により遠心的に拡大します。このとき、細胞壁成分を含む膜小胞が微小管に沿ってフラグモプラスト赤道面に集積・融合し、細胞板が形成されます。その結果、細胞板はフラグモプラスト微小管の重合と脱重合に伴い細胞中央部から周縁部に拡大します(図3)。細胞板形成を担うフラグモプラストがどのようなメカニズムで構築し、発達するのかを明らかにするために、植物特異的キネシン(Hiwatashi et al. 2008)、2型ユビキチン様ドメインタンパク質の2つの因子に注目して解析しています。
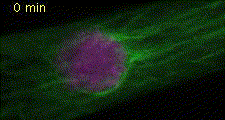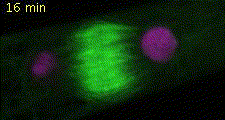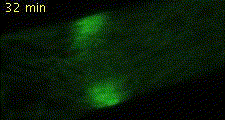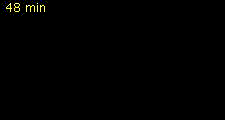
図2 植物細胞の分裂 微小管(緑色)、DNA(マゼンダ色)
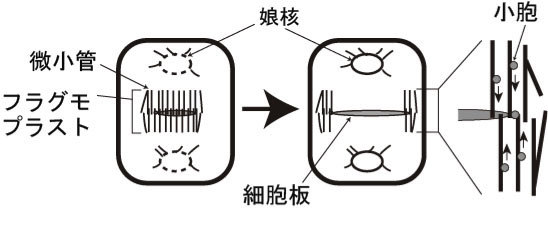
図3 植物細胞の細胞質分裂の模式図
先端成長は細胞の極性成長の典型例で、菌類、植物、動物などの幅広い生物種で見られます。従って、先端成長の制御機構の解明は、細胞の形態形成や機能の制御系を理解するためには不可欠です。植物の先端成長は、コケ植物やシダ植物の原糸体、種子植物の根毛や花粉管などでみられます。本研究では、ヒメツリガネゴケ原糸体の先端成長をモデルにして、先端成長における微小管ダイナミクスの制御機構(図4)、先端成長に対する微小管とアクチン繊維の相互作用、これらの細胞骨格の関連因子の役割とその制御システム(図5)を研究しています(Hiwatashi et al 2014)。
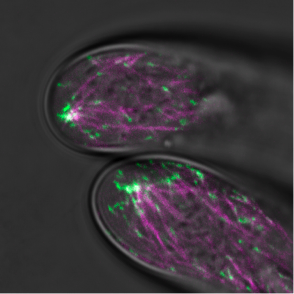
図4 ヒメツリガネゴケ原糸体先端領域での微小管
コケのモデル植物ヒメツリガネゴケPhyscomitrella patensの原糸体頂端細胞の先端領域。
先端領域に微小管重合端が集合してできた束が観察される。研究により、この束を介して成長の方向と速度が制御されることがわかった。マゼンダ色と緑色は、それぞれ微小管とその重合端を示す。
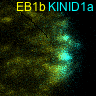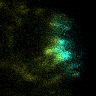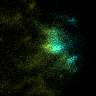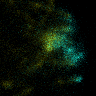
図5 先端成長領域におけるキネシンKINID1(シアン色)と微小管重合端(黄色)の動態
これまで述べたように、細胞骨格である微小管は細胞の分裂や伸長の制御に不可欠です。動物細胞では中心体が微小管形成の中心的な役割を果たしますが,陸上植物では中心体が見られないため,微小管形成を担う分子メカニズムは動物細胞に比べて不明な点が多く残されています。近年,既存の微小管上から微小管が形成されることがわかり,動植物細胞に共通なタンパク質複合体オーグミンが微小管依存的微小管形成に機能することが明らかになりました(Nakaoka et al. 2012)。オーグミンは8種類のサブユニットで構成されていますが、そのうちサブユニット8(AUG8)は動物と植物でアミノ酸配列の類似性は低く、また陸上植物の系統でAUG8遺伝子数が顕著に増幅していることがわかっています。このことから,植物細胞の進化に伴ってAUG8の機能が多様化した可能性が考えられますが,被子植物以外の陸上植物におけるAUG8の機能は不明のままです。陸上植物におけるAUG8機能の多様化とその全体像を明らかするために,基部陸上植物ヒメツリガネゴケのAUG8の機能解析を行っています。
植物の形と永遠の命
多能性幹細胞はさまざまな細胞や組織を作り出しながら、自己複製を繰り返し維持されます。植物では頂端分裂組織に存在する多能性幹細胞が永続的に維持され、根や茎葉を作り出します。この多能性幹細胞が永続的に維持されるという性質により、樹齢が千年単位の屋久杉スギのように、非常に長い寿命をもつ植物があります。また、組織・器官形成においても様々な幹細胞が形成、維持されて複雑な形態を作ります。幹細胞の形成や永続的な維持機構を明らかにするために、ヒメツリガネゴケ(図6)、シロイヌナズナ、ミナトカモジグサを材料に用いて多能性幹細胞を研究しています(Okano et al. 2010, Aoyama et al. 2012)。
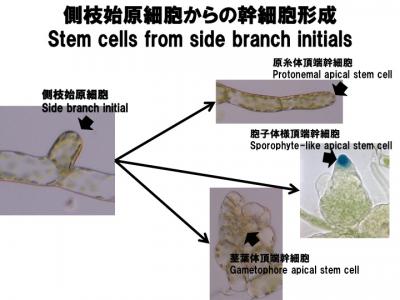
図6 ヒメツリガネゴケ側枝始原細胞からの幹細胞形成
植物は分化した細胞から容易に個体が再生します。それでは、植物において個体再生のしくみはどのようになっているのでしょうか。ニンジンでは茎の一部から未分化的な細胞が作られ、この一部の細胞から個体が形成されます(図7)。この過程では、さまざまな転写調節因子がはたらいていることがわかっています(Hiwatashi and Fukuda 2000)。ミナトカモジグサを材料に用いて、個体再生に関わる転写調節因子の解析を行っています。
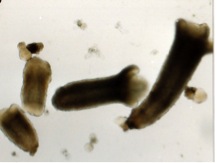
図7 未分化細胞から形成されたニンジンの胚(不定胚)
作物の分子育種
ミナトカモジグサ (Brachypodium distachyon) は、温帯性のイネ科穀物(温帯性禾穀類)で、(1)個体サイズが比較的小さく、実験室で栽培が容易である、(2)生活環が10-18週間と短い、(3)イネ科草本植物では300Mbと最もゲノムサイズが小さい、(4)形質転換が可能であるという特徴を持っています(図8)。有用遺伝子の遺伝子改変を行うために、高効率の形質転換系、エストロジェン遺伝子発現誘導系やCRISPR/Cas9系による遺伝子ターゲティング系を確立する研究を行っています。また、組織培養法を用いた器官再生の基盤技術の研究も行っています。

図8 温帯性イネ科のモデル植物ミナトカモジグサBrachypodium distachyonの植物体の地上部。
Brachypodium distachyon plants
食料・バイオマスの生産に有用な遺伝子を探索し、解析することが効率的にできる。得られた研究成果は温帯性イネ科植物の品種改良に利用される。
3. 研究室のメンバー募集
日渡研究室では、生物の研究が好きな方、思う存分に実験してみたい方、新たな分野を開拓したい方、将来研究者や技術者になりたいと考えている大学院生や学部学生、また、研究分野に興味があるポスドクの方、バイオテクノロジー分野で学位取得にチャレンジしてみたいと考えておられる社会人の方などを歓迎します。
研究は決して予定通りに進むことはありません。むしろ、予定通り“予定通り進まない”ということばかりです。でも、“これって面白いなあ!このしくみはどうなっているだろう?自分の手で解き明かしたい!!”という意欲があれば、大丈夫。研究室の仲間や他の研究者と連携し切磋琢磨することにより、さまざまな難題を突破して、自分の目的を果たすことができます。きっとゴールにたどり着いたときには、教養や技術を自分のものにしているでしょうし、また研究や仕事の幅が広がっていることでしょう。そして、一回りも二回りも大きな人間となって、次のステップでも活躍できるはずです。
細胞1つとっても謎だらけです。オリジナリティーのある先駆的な研究を通して、一緒に生物の謎を解き明かしていきませんか。まずはお気軽にご連絡いただければと思います。
4. Welcome to the Hiwatashi lab!
Plant Molecular Genetics and Breeding Lab (English)
How plant cells grow, one of the most fundamental aspects of plant biology, remains an open question. In addition, during land plant evolution, genetic and functional changes of regulatory mechanisms drive morphological innovations. Our research focuses on elucidating how molecular mechanisms within the cell direct and regulate plant cell division, growth, and morphogenesis, and understanding how the mechanism related to the innovation was changed during plant evolution.
Current projects are below
(1) Elucidation of the regulatory mechanism on plant cell division
(2) Spatial and temporal regulation of tip growth regulators in the moss
(3) Understanding of the stem cell initiation and maintenance in land plants
(4) Establishment of molecular genetics tools for bleeding in cereals
Recruiting lab members
The Hiwatashi lab would very welcome applicants who be highly motivated to conduct research on plants and who enjoy a challenge, graduate and undergraduate students who wish to be researchers in the future, postdoctoral researchers who wish to move to the new research field, and working persons who wish to learn new skills.
It’s our great pleasure to answer an open question on biology with you. We would be happy to hear from you.
Yuji Hiwatashi. Ph.D
Associate Professor
Plant Molecular Genetics and Breeding Laboratory
School of Food, Agricultural and Environmental Sciences
2-2-1 Hatadate, Taihaku, Sendai, Miyagi 982-0215, Japan
Phone: +81-22-245-1214
FAX: +81-22-245-1534
E-mail: hiwatash(a)myu.ac.jp
(pls replace (a) with @)
RESEARCH
Dr. Yuji Hiwatashi’s research is primarily related to understanding of the molecular basis on cellular process such as cell division and growth in multicellular organisms and the genetic changes associated with the evolution of cellular and developmental process in land plants.
In Tohoku University, he found that four different HD-Zip I homeobox genes CHBs were expressed in a temporally and spatially regulated manner during carrot somatic embryogenesis. This result suggested that these CHB genes may be involved in the differentiation of specific tissues during somatic embryogenesis (Hiwatashi and Fukuda, 2000).
In the National Institute for Basic Biology (NIBB), he performed the research with the moss Physcomitrella patens and established the gene-trap/enhancer-trap system in P. patens (Nishiyama et al. 2000; Hiwatashi et al. 2001; Fujita et al. 2005), which was the first method for gene discovery based on the phenotype and is a unique method so far. The gene-trap/enhancer-trap system is frequently used by other researchers (Hayashida et al. 2005; Kofuji et al. 2008). In NIBB, the aim of his study was to understand the molecular mechanisms of plant development, and he has conducted mainly four projects focusing: (1) the regulatory mechanism of plant mitosis and cytokinesis via microtubule organisation (Hiwatashi et al., 2008; Nakaoka et al., 2012), (2) stem cell initiation and maintenance (Okano et al., 2009, Aoyama et al., 2012), (3) auxin flow system and its evolutionary implications in land plants (Fujita et al. 2008), and (4) nuclear genome project of P. patens (Banks et al., 2011).
In National Plant Phenomics Centre, IBERS, Aberystwyth University, UK, he conducted the projects to elucidate the molecular mechanisms responsible for the microtubule dynamics in plant cell growth and division using molecular genetics and live-cell imaging. The high quality live imaging analysis was established to observe the dynamics of MTs and other MT-regulators in tip-growing cells, caulonemal apical cells of P. patens. Using this system combined with molecular genetics, he found that the regulation of tip growth via MTs dynamics that is maintained by the plant-specific kinesins (Hiwatashi et al. 2014). The augmin protein complex plays roles in the microtubule (MT) generation on the existing MTs. The AUG8 genes, encoding one of eight augmin subunits, are highly duplicated within land plants, suggesting that the AUG8 proteins are associated with the innovation of the MT-organizing network during the land plant evolution. For better understanding of biological function of AUG8 in the plant cells, AUG8s were analysed in the basal land plant, P. patens.
AT present, the four projects are in progress in Miyagi University: (1) Molecular mechanism of tip growth of P. patens, (2) Regulatory mechanism of plant cell division of P. patens, (3) Stem cell formation and maintenance of P. patens, angiosperm Brachypodium distachyon, and Arabidopsis thaliana, (4) Establishment of molecular genetics tools for B. distachyon.
Publications
Original articles
1. Sakakibara, K., Reisewitz, P., Aoyama, T., Friedrich, T., Ando, S., Sato, Y., Tamada, Y., Nishiyama, T., Hiwatashi, Y., Kurata, T., Ishikawa, M., Deguchi, H., Rensing, A.S., Werr, W., Murata, T., Hasebe, M., and Laux, T. (2014) WOX13-like genes are required for reprogramming of leaf and protoplast cells into stem. Development. 141: 1660-1670.
2. Xu, B., Ohtani, M., Yamaguchi, M., Toyooka, K., Wakazaki, M., Sato, M., Kubo, M., Nakano, Y., Sano, R., Hiwatashi, Y., Murata, T., Kurata, T., Yoneda, A., Kato, K., Hasebe, M., and Demura, T. (2014) Contribution of NAC transcription factors to plant adaptation to land. Science. 343:1505-1508.
3. Hiwatashi, Y., Sato, Y., and Doonan, H.J. (2014) Kinesins have a dual function in organizing microtubules during both tip growth and cytokinesis in Physcomitrella patens. Plant Cell. 26: 1256-1266.
4. Mano, H., Fujii, T., Sumikawa, N., Hiwatashi, Y., and Hasebe, M. (2014) Development of an Agrobacterium-mediated stable transformation method for the sensitive plant Mimosa pudica. PLoS ONE. 9: e88611.
5. Kubo, M., Imai, A., Nishiyama, T., Ishikawa, M., Sato, Y., Kurata, T., Hiwatashi, Y., Reski, R., and Hasebe, M. (2013) A stable induction system with β-estradiol in the moss Physcomitrella patens. PLoS ONE. 8: e77356.
6. Sakakibara, K., Ando, S., Yip, K.H., Tamada, Y., Hiwatashi, Y., Murata, T., Deguchi, H., Hasebe, M., and Bowman, L.J. (2013) KNOX2 Genes regulate the haploid-to-diploid morphological transition in land plants. Science. 339: 1067-1070.
7. Suetsugu, N, Sato, Y., Tsuboi, H., Kasahara, M., Imaizumi, T., Kagawa, T., Hiwatashi, Y., Hasebe, M., and Wada, M. (2012) The KAC family of kinesin-like proteins is essential for the association of chloroplasts with the plasma membrane in land plants. Plant and Cell Physiology. 53:1854-1865.
8. Aoyama, T., Hiwatashi, Y., Shigyo, M., Kofuji, R., Kubo, M., Ito, M., and Hasebe, M. (2012) AP2-type transcription factors determine stem cell identity in the moss Physcomitrella patens. Development. 139: 3120-3129.
9. Nakaoka, Y., Miki, T., Fujioka, R., Uehara, R., Tomioka, A., Obuse, C., Kubo, M., Hiwatashi, Y., and Goshima, G. (2012) An inducible RNAi system in Physcomitrella patens reveals a dominant role of augmin in phragmoplast microtubule generation. Plant Cell. 24:1478-1493.
10. Aya, K., Hiwatashi, Y., Kojima, M., Sakakibara, H., Ueguchi-Tanaka, M., Hasebe, M., and Matsuoka, M. (2011) The gibberellin perception system evolved to regulate a pre-existing GAMYB-mediated system during land plant evolution. Nature Communications. 2:544.
11. Ishikawa, M., Murata, T., Sato, Y., Nishiyama, T., Hiwatashi Y., Imai, A., Kimura, M., Sugimoto, N., Akita, A., Oguri, Y., Friedman, W.E., Hasebe, M., and Kubo, M. (2011) Physcomitrella cyclin-dependent kinase A links cell cycle reactivation to other cellular changes during reprogramming of leaf cells. Plant Cell. 23:2924-2938.
12. Banks, J.A., Nishiyama, T., Hasebe, M., Bowman, J.L., Gribskov, M., dePamphilis, C., Albert, V.A., Aono, N., Aoyama, T., Ambrose, B.A., Ashton, N.W., Axtell, M.J., Barker, E., Barker, M.S., Bennetzen, J.L., Bonawitz, N.D., Chapple, C., Cheng, C., Correa, L.G., Dacre, M., DeBarry, J., Dreyer, I., Elias, M., Engstrom, E.M., Estelle, M., Feng, L., Finet, C., Floyd, S.K., Frommer, W.B., Fujita, T., Gramzow, L., Gutensohn, M., Harholt, J., Hattori, M., Heyl, A., Hirai, T., Hiwatashi, Y., Ishikawa, M., Iwata, M., Karol, K.G., Koehler, B., Kolukisaoglu, U., Kubo, M., Kurata, T., Lalonde, S., Li, K., Li, Y., Litt, A., Lyons, E., Manning, G., Maruyama, T., Michael, T.P., Mikami, K., Miyazaki, S., Morinaga, S., Murata, T., Mueller-Roeber, B., Nelson, D.R., Obara, M., Oguri, Y., Olmstead, R.G., Onodera, N., Petersen, B.L., Pils, B., Prigge, M., Rensing, S.A., Riaño-Pachón, D.M., Roberts, A.W., Sato, Y., Scheller, H.V., Schulz, B., Schulz, C., Shakirov, E.V., Shibagaki, N., Shinohara, N., Shippen, D.E., Sørensen, I., Sotooka, R., Sugimoto, N., Sugita, M., Sumikawa, N., Tanurdzic, M., Theissen, G., Ulvskov, P., Wakazuki, S., Weng, J.K., Willats, W.W., Wipf, D., Wolf, P.G., Yang, L., Zimmer, A.D., Zhu, Q., Mitros, T., Hellsten, U., Loqué, D., Otillar, R., Salamov, A., Schmutz, J., Shapiro, H., Lindquist, E., Lucas, S., Rokhsar, D., and Grigoriev, I.V. (2011) The Selaginella genome identifies genetic changes associated with the evolution of vascular plants. Science. 332: 960-963.
13. Yokoyama, R., Uwagaki, Y., Sasaki, H., Harada, T., Hiwatashi, Y., Hasebe, M., and Nishitani, K. (2010) Biological implications of the occurrence of 32 members of XTH (xyloglucan endotransglucosylase/hydrolase) family of proteins in the bryophyte Physcomitrella patens. Plant Journal. 64: 645-56.
14. Hayashi, K., Horie, K., Hiwatashi, Y., Kawaide, H., Yamaguchi, S., Hanada, A., Nakashima, T., Mander, L.N., Yamane, H., Hasebe, M., and Nozaki, H. (2010) Endogenous diterpenes derived from ent-kaurene, a common gibberellin precursor, regulate protonema differentiation of the moss Physcomitrella patens. Plant Physiology. 153: 1085-1097.
15. Mikami, K., Saavedra, L., Hiwatashi, Y., Uji, T., Hasebe, M., and Sommarin, M. (2010) A dibasic amino acid pair conserved in the activation loop directs plasma membrane localization and is necessary for activity of plant type I/II phosphatidylinositol phosphate kinase. Plant Physiology. 153: 1004-1015.
16. Okano, Y., Aono, N., Hiwatashi, Y., Murata, T., Nishiyama, T., Ishikawa, T., Kubo, M., and Hasebe, M. (2009) A polycomb repressive complex 2 gene regulates apogamy and gives evolutionary insights into early land plant evolution. Proceeding of the National Academy of Science of the United States of America 106: 16321-16326.
17. Oda, Y., Hirata, A., Sano, T., Fujita, T., Hiwatashi, Y., Sato, Y., Kadota, A., Hasebe, M., and Hasezawa, S. (2009) Microtubules regulate dynamic organization of vacuoles in Physcomitrella patens. Plant and Cell Physiology 50: 855-868.
18. Saavedra, L., Balbi, V., Dove. S.K., Hiwatashi, Y., Mikami, K., and Sommarin, M. (2009) Characterization of phosphatidylinositol phosphate kinases from the moss Physcomitrella patens: PpPIPK1 and PpPIPK2. Plant and Cell Physiology 50: 595-609.
19. Hiwatashi, Y., Obara, M., Tomomichi F., Murata, T., and Hasebe, M. (2008) Kinesins are indispensable for interdigitation of phragmoplast microtubules in the moss Physcomitrella patens. Plant Cell 20: 3094-3106.
20. Abe, J., Hiwatashi, Y., Ito, M., Hasebe, M., and Sekimoto, H. (2008) Expression of exogenous genes under the control of endogenous HSP70 and CAB promoters in the Closterium peracerosum-strigosum-littorale complex. Plant and Cell Physiology 49: 623-633.
21. Fujita, T., Sakaguchi, H., Hiwatashi, Y., Steven J. Wagstaff, S.J., Ito, M., Deguchi, H., Sato, T., and Hasebe, M. (2008) Convergent evolution of shoots in land plants: lack of auxin polar transport in moss shoots. Evolution and Development 10: 176-186.
22. Hayashida, A., Takechi, K., Sugiyama, M., Kubo, M., Itoh, R.D., Takio, S., Fujita, T., Hiwatashi, Y., Hasebe M., and Takano H. (2005) Isolation of mutant lines with decreased numbers of chloroplasts per cell from a tagged mutant library of the moss Physcomitrella patens. Plant Biology 7: 300-306.
23. Hiwatashi, Y., Nishiyama, T., Fujita, T., and Hasebe, M. (2001) Establishment of gene- and enhancer-trap systems in the moss Physcomitrella patens. Plant Journal 28: 105-116.
24. Nishiyama, T., Hiwatashi, Y., Sakakibara, K., Kato, M., and Hasebe, M. (2000) Tagged mutagenesis and gene-trap in the moss, Physcomitrella patens by the shuttle mutagenesis. DNA Research 7: 9-17.
25. Hiwatashi, Y. and Fukuda, H. (2000) Tissue-specific localization of mRNA for carrot homeobox genes, CHBs, in carrot somatic embryos. Plant and Cell Physiology 41: 639-643.
Reviews
1. Kofuji, R., Yoshimura, T., Inoue, H., Sakakibara, K., Hiwatashi, Y., Kurata, T., Aoyama, T., Ueda, K., and Hasebe, M. (2008) Gametangia development in the moss Physcomitrella patens. In Knight, C., Cove, D., and Peroud, P-.F. (eds.) “The moss Physcomitrella” Annual Plant Reviews 36: 167-181. Blackwell publishing Ltd.
2. Hasebe, M., Fujita, T., Kurata, K., Sato, Y., Kubo, M., Murata, T., Aoyama, T., Mikami, K., Ishikawa, M., Hiwatashi, Y., Aono, T., Shinohara, N, Nishiyama, T., and Tanahashi, T. (2007) Evolution of developmental genes In Shimuzu, K. and Hasebe, M. (eds.) “Plant Evolution”, pp 163-173. SHUJUNSYA Co., Ltd. (in Japanese)
3. Fujita, T., Nishiyama, T., Hiwatashi, Y., Mitsuyasu Hasebe (2004) Gene tagging, gene/enhancer-trap, and full-length cDNA overexpression in Physcomitrella patens. In Wood, A.J. Oliver, M., and Cove, D. (eds.) “New Frontiers in Bryology: Physiology, Molecular Biology & Applied Genomics”, pp 111-132. Kluwer academic publishers.
4. Hasebe, M., Hiwatashi, Y., and Nishiyama, T. (2001) Physcomitrella patens and gene-targeting. In Sasaki, T., Tabata, T., and Shimamoto, K. (eds.) “Protocols for Plant genome research”, pp 164-167. SHUJUNSYA Co., Ltd. (in Japanese)
5. Hiwatashi, Y., Nishiyama, T., and Hasebe, M. (2000) Physcomitrella patens subsp. patens - plant hormone, differentiation and evolution: a review. Bryological Research 7: 276-284. (in Japanese)
Other reports, popular articles, book reviews etc.
1. Hiwatashi, Y. (2003) Report on the annual international meeting for moss experimental research, MOSS2002. Biological Science News 374: 9-10. (in Japanese)
2. Mishima, M., Nishiyama, T, Hiwatashi, Y., and Tsukaya, H. (2001) Fifty keywords in Botany. In Isshiki, K. (ed.) “Understanding Botany”, pp 140-146. ASAHI SHINBUN. (in Japanese)

